背景
2021年5月29日開始,社群平台流傳文章搭配圖卡指稱:「今天在家,我看了美國FDA所屬的Clinicaltrail網站,查詢台灣討論度較高的三個疫苗,臨床試驗的進度。目前它們所處的階段是完成臨床三期的收案,在等最後數據分析,最快估計要今年年底才會完成。
白話文:AZ、莫德納(Moderna),都是完成二期試驗,美國就發「緊急使用授權」(EUA),進行施打,連BNT也是。台灣國產的兩支疫苗,高端跟聯亞,已經參照美國FDA和WHO的指引,將第二期的臨床受試人數提升到3,000多人。根據陳建仁前副總統在媒體的專訪,他已經接受高端疫苗的二期人體實驗後,沒有太大的不適與副作用,且經過4000多人的分析後,不良反應率偏低。若未來中和抗體量能與其他廠牌疫苗保護力相同,就可以接受食藥署審查,審查結果無問題的話,可比照歐美國家採緊急使用授權上市。
我相信,食藥署對疫苗要求相當嚴格,出產的疫苗品質一定會符合國際標準。不論是外購疫苗,還是國產疫苗,都是我們對抗疫情的重要方式。但我們若能自己自製疫苗,就更能長期對抗疫情。所以,不要再抹黑國產疫苗,外購、自製一樣好。
(圖片歡迎大家公開下載、分享,不必問我,願意標記我,我會很高興XD」

圖1:社群平台流傳圖卡
查核
爭議點一、傳言稱「AZ、莫德納(Moderna),都是完成二期試驗,美國就發「緊急使用授權」(EUA),進行施打,連BNT也是」,美國核發緊急授權的規定為何?
查核中心檢視美國食品藥物管理局(US Food & Drug Administration,下簡稱FDA)對緊急使用授權的標準解釋:
FDA對於COVID-19疫苗的緊急使用授權審查,必須「基於第三期臨床試驗」或是此類試驗的中期分析,也就是在臨床試驗結束前,當相關數據已經達到預先設定的有效性標準時,針對相關數據所做出的分析報告。
An EUA request for a COVID-19 vaccine can be submitted to FDA based on a final analysis of a phase 3 clinical efficacy trial or an interim analysis of such trial, i.e., an analysis performed before the planned end of the trial once the data have met the pre-specified success criteria for the study’s primary efficacy endpoint.
為了確保安全性,藥廠除了需要提交一、二期的所有安全相關數據以外,也需提供第三期試驗中,至少過半受試者完成接種後至少兩個月的追蹤數據。此外,FDA也要求藥廠要提出3000名以上第三期受試者的安全性數據,且當中應包含一定比例的、在疫苗接種後一個月經歷嚴重不良事件與特殊不良事件的受試者數據。
From a safety perspective, FDA expects an EUA submission will include all safety data accumulated from phase 1 and 2 studies conducted with the vaccine, with an expectation that phase 3 data will include a median follow-up of at least 2-months (meaning that at least half of vaccine recipients in phase 3 clinical trials have at least 2 months of follow-up) after completion of the full vaccination regimen. In addition, FDA expects that an EUA request will include a phase 3 safety database of well over 3,000 vaccine recipients, representing a high proportion of participants enrolled in the phase 3 study, who have been followed for serious adverse events and adverse events of special interest for at least one month after completion of the full vaccination regimen.
爭議點二、各疫苗目前取得美國緊急使用授權的情況為何?
(一)美國FDA通過輝瑞緊急授權時的審查說明:
查核中心檢視輝瑞公司2020年7月的新聞稿,輝瑞在2020年7月27日宣布在全球展開mRNA疫苗的2/3期安全性與有效性臨床試驗。預計招募3萬名以上的試驗者(18-85歲),並在美國、阿根廷、巴西、德國展開試驗。預計以1:1隨機分配的方式,將受試者分成施打疫苗組、生理食鹽水組(安慰劑)對照組,獲取疫苗的安全性、有效性數據。
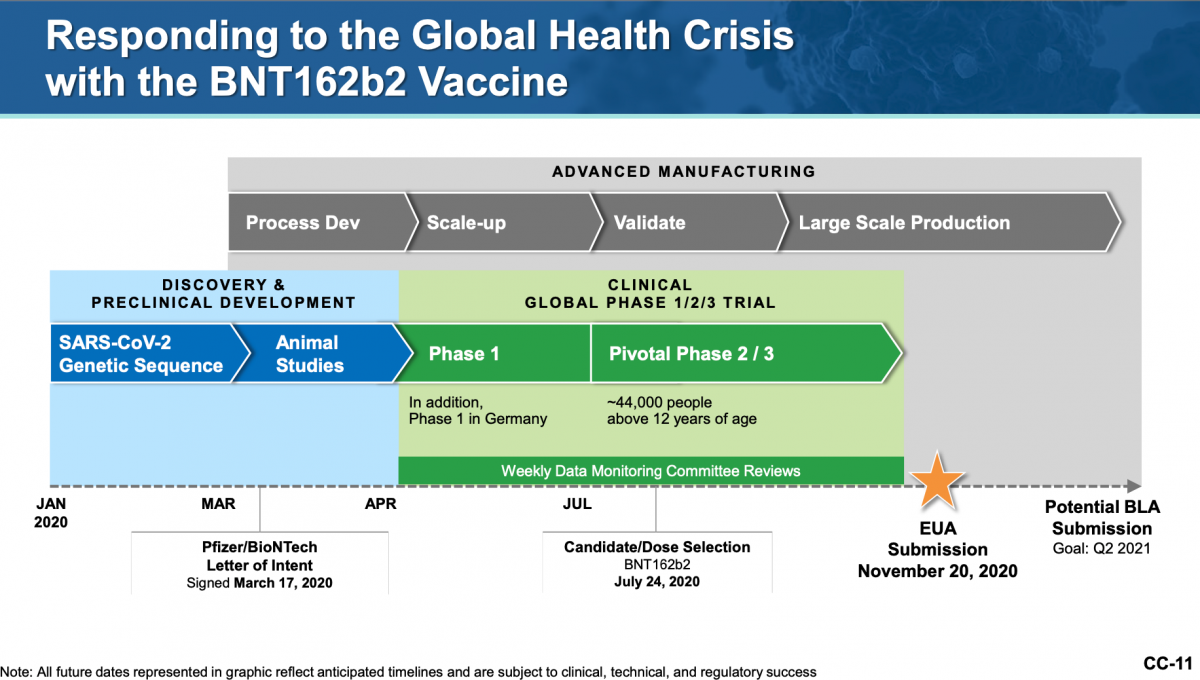
圖2:輝瑞疫苗臨床試驗進程擷圖
美國FDA在2020年12月11日通過「輝瑞疫苗」的緊急授權。其授權說明書中指出,FDA通過緊急授權,主要是檢視正在進行臨床試驗中的「1/2/3期」(on going 1/2/3 trial)中, 44,000名12歲以上受試者安全性與有效性的數據。
針對輝瑞疫苗的安全性、有效性數據,FDA是根據正在進行中的37,586人(16歲以上)大型隨機分配試驗的數據進行評估。臨床試驗中18,801 人施打了疫苗,18,785 人施打生理食鹽水(安慰劑)。安全性方面,觀察一半的受試者施打疫苗2個月的狀況,常見的副作用包括,注射部位疼痛、疲倦、頭痛、肌肉疼痛、關節疼痛和發燒。值得注意的是,第二次注射疫苗後,出現副作用的人比第一次注射的疫苗更多。有效性方面,比起安慰劑組,施打疫苗組能預防 COVID-19的保護力為 95%。
另根據輝瑞公司2021年5月7日公布的新聞稿,目前輝瑞正在以滾動式方式提出相關試驗數據資料,向美國FDA申請藥證(BLA),獲得全面批准上市。
(二)美國FDA通過莫德納疫苗緊急授權時的審查說明:
美國FDA在2020年12月18日通過莫德納疫苗的緊急授權。其授權說明書中指出,FDA的審查是基於正在進行的第三期試驗,多達30,000位受試者的安全性與有效性數據評估。
可用安全性數據包括 30,351 名受試者,以隨機分配成兩組,其中15,185 人施打疫苗,另外15,166 人施打生理鹽水安慰劑,並觀察兩個月。最常出現的副作用包括注射部位疼痛、疲倦、頭痛、肌肉疼痛、寒顫、關節疼痛、噁心和嘔吐以及發燒。第二次接種後出現這些副作用的人比第一次給藥後更多。
可用的有效性數據評估則是基於正在進行的隨機分配(施打疫苗組、安慰劑組)試驗,共有28,207 名參與者進行的分析。這些參與者中,14,134 人接受了疫苗,14,073 人接受了安慰劑。比起安慰劑組,施打疫苗組有94.1%的保護力(疫苗組中有 11 例感染 COVID-19,安慰劑組中有 185 例感染)。
(三)美國FDA是否批准AZ疫苗的緊急授權?
截至目前(2021年6月7日)美國FDA通過輝瑞、莫德納、嬌生(楊森)疫苗,但尚未通過AZ疫苗的緊急授權。
根據阿斯利康製藥公司(Astrazeneca)3月25日發布的新聞稿,阿斯利康公司準備向美國FDA申請緊急授權。
新聞稿指出,根據在美國進行的第三期臨床試驗結果初步分析, COVID-19 疫苗的保護力為 76%、對重症或危重症和住院治療有 100% 的療效、 65 歲及以上的參與者中有 85% 的保護力。未來幾週將準備向美國FDA送出相關資料,申請「緊急使用授權」。
爭議點三、台灣專家如何解讀美國FDA針對新冠疫苗的緊急使用授權?
查核中心採訪國家衛生研究院感染症與疫苗研究所副研究員級主治醫師齊嘉鈺、陽明交通大學公共衛生研究所副教授楊秀儀。
(一)齊嘉鈺說,根據美國FDA規定,授予疫苗「緊急授權」(EUA)要能符合安全性、有效性兩大標準。根據過往疫苗研發過程,臨床實驗的第一期,會透過少數病患實驗找出有效的疫苗劑量、第二期再擴大受試者,檢驗疫苗的安全。臨床三期,受試者基數擴大,能找出二期實驗中看不出來的「嚴重不良反應」比例,以及疫苗的有效性。事實上,就算臨床三期做完上市後,還是要繼續觀察大規模施打的狀況,才能發現百萬分之一的「嚴重不良反應」。
齊嘉鈺說,現在美國的輝瑞、莫德納疫苗,目前皆未完成臨床三期的實驗,但是有完成臨床三期的「期中報告」,才得到美國FDA的緊急授權,得以上市緊急大規模施打。
根據FDA的標準,輝瑞、莫德納的臨床三期期中報告需要有施打的有效性、至少要有「追蹤一半以上的受試者接種2個月後的情況」,以符合FDA要求的「安全性」、「有效性」標準。
齊嘉鈺說,根據過往經驗,要完成三期試驗,理論上要追蹤受試者接種後狀況1-2年。但這不符目前全球疫情嚴峻的情形,以及立即取得的需求。不過,美國FDA授予「緊急授權」仍有一定的規範及標準。
(二)楊秀儀表示,一個新藥物或疫苗研發,常規當然必須進行到第三期,但會需要緊急授權的情況,就不是一個常態。國際對緊急授權都有相關法令規範和標準,雖然緊急,但相關資料都必須受到嚴格審核,符合科學要求才會給予授權,但沒有規定一定要完成三期才能緊急授權。必須看環境、看情形、看疫情狀況,給予緊急授權是否是「利大於弊」來決定。
綜合以上,輝瑞、莫德納疫苗在完成二期試驗之後,正在進行三期試驗時,以三期試驗中的期中分析取得美國FDA的緊急使用授權。但截至6月7日為止,AZ疫苗尚未取得美國緊急授權。
爭議點四、傳言圖卡稱「高端/聯亞疫苗,擬比照國外於二期試驗後授權」,是否屬實?
(一)根據高端疫苗公司4月28日公布的新聞稿指出,COVID-19疫苗(MVC-COV1901)二期臨床試驗已達成3700位受試者第二劑施打,符合試驗設計與法規所需樣本數。
查核中心曾於查核報告1017中採訪食藥署,以及相關專家。食藥署於2020年12月29日核准高端執行第二期臨床試驗,其第二期臨床主試驗是從2021年1月份開始執行,做到5月27日,共收案3700名成年人,並在5月27日蒐集完所有安全性資料和要檢測中和抗體的血液檢體,送出資料,交由獨立資料處理單位解盲。
(二)食藥署指出,因應新冠肺炎疫情,如何加速取得疫苗是重要的防疫政策。除仰賴洽購國際疫苗外,建立國內疫苗自製量產能力也是關鍵。衛福部以推動國產疫苗上市為目標,規劃研發各階段應達成的時程、指標及所需經費,由政府提供補助方式,鼓勵並加速國內疫苗開發上市。
食藥署表示,由於國內疫情環境難以執行大規模評估疫苗保護力的臨床試驗,經專家會議
討論,考量科學理論基礎及風險利益評估,因此要求第二期臨床試驗收納至少 3500 ⼈以上受試者,以偵測發⽣率千分之⼀的不常⾒不良反應,以符合國際間對疫苗安全性的審查標準,並以免疫原性資料作為支持疫苗療效的佐證資料。
至於外界質疑「國產疫苗僅做完第二期就可申請緊急授權」,食藥署說,因應國內緊急公衛需求,國產疫苗的臨床試驗結果、製程管控及藥毒理試驗等資料,仍需經過嚴謹審查,確認疫苗的品質、安全及有效性後,食藥署會召集專家小組評估科學數據,才會決定是否給予緊急使用授權。
食藥署也指出,目前國產疫苗廠商都已積極規劃到其他國家進行第 3 期臨床試驗,也開始與國外法規單位溝通,以取得國際認證為目標。食藥署也將持續追蹤國內外臨床試驗進度,並持續要求廠商提供常規核准所需的臨床安全及療效數據,支持國產疫苗之安全性與療效性。
綜合以上,高端疫苗目前已完成第二期主試驗,並等待試驗數據解盲;食藥署將依據獨立資料分析單位解盲結果,再送交給專家小組審查,確認疫苗各指標後,才會決定是否核准其緊急使用權。截至目前(6月8日),國產疫苗尚未取得台灣食藥署緊急授權。
爭議點五、國產疫苗以「2期臨床試驗結果」申請食藥署的緊急使用授權,專家提出相關建議和不同觀點,查核中心整理如下:
(一)齊嘉鈺說,在觀察「台灣國產疫苗」是否通過緊急授權時,與其執著於「是否完成三期」,更應該扣問,如何在「尚未完成三期」的情況下,就二期的臨床實驗結果,確保疫苗的安全性、有效性。
齊嘉鈺說,一般傳統三期試驗會以1:1或2:1分成疫苗組、對照組(安慰劑),讓受試者回到社區,觀察其感染比例,作為疫苗保護力的數據。而且,面對嚴重疫情,必須盡快獲得有效預防疾病的疫苗前提下,美國FDA啟動緊急授權機制,仍堅持規範三期試驗至少要達到3000人以上,且觀察一半受試者至少2個月以上,提供安全性及有效性資料的期中報告。後續並持續監測,直到完成臨床試驗。
齊嘉鈺說,國產疫苗目前是用「擴大二期臨床實驗」(受試者超過3000人)的結果,向台灣食藥署申請緊急授權。但是否就能以「擴大二期試驗」代替傳統的三期試驗,可以從「二期試驗結果」是否足夠證明疫苗的安全性、有效性,進行分析。
目前台灣國產疫苗中,二期試驗受試者雖為3000人,但與其他疫苗三期試驗中的數萬人有差距,並無法類比。此外,二期試驗雖然有做對照組,但對照組比例過少,且試驗期間台灣沒有真正的社區感染,因此即使是對照組,發生確診的個案數可能都非常少,難以證明疫苗的有效力。若僅完成第二期臨床試驗,國產疫苗可能會尋求以「替代性指標」來評估疫苗的有效性。
因應世界疫苗的短缺及疫情緊迫,全世界目前討論朝向以「免疫生成性」取代傳統三期試驗,多以「中和抗體」作為指標。根據科學資料推估,當血液中和抗體效價越高,疫苗的有效性也越高。
世界衛生組織(WHO)5月底也曾討論,是否能以「免疫生成性」取代三期試驗。但會議中並沒有決議和答案,明確的結論就是目前的科學證據尚未足夠,是否就能以「替代性指標」等同於三期試驗中「疫苗的有效性」,還需要更多的科學證據。
齊嘉鈺說,現在國外多數疫苗,如輝瑞、莫德納等,都是有提出三期的期中報告送交審查,才拿到緊急授權。假設未來國產疫苗在沒有「第三期試驗」下,就通過緊急授權上市施打,國人施打疫苗想出國,國際之間是否就會認定國產疫苗有保護力,且通過國外審查標準,確實是一大挑戰。
齊嘉鈺說,緊急授權的目的就是為了因應傳染病的緊急狀態,但從美國FDA經驗來看,緊急授權仍有一定審查標準,評估疫苗是否符合標準。目前國產疫苗的二期試驗,是否能提供一定安全性、有效性的數據,台灣食藥署必須公開說明和訂定緊急授權的標準,若是選擇以「替代指標」評估疫苗的有效性,也應說明其可行性、確效性及合理性,再交給專家委員小組認定是否通過審查,讓科學回到科學。
(二)查核中心諮詢前疾管署署長、前陽明大學校長郭旭崧。他表示,現在外界爭議的緊急授權,必須先有一個認知,緊急授權是為了緊急使用,並不是要給正式的藥證。如果是要給藥證,那做第三期臨床試驗是免不了,所以現在國外取得緊急授權的各大藥廠也都是一樣,雖然做了三期,但三期也還沒結束。一般三期臨床試驗要3到4年時間長期觀察,但現在通過緊急授權的疫苗都是短時間就做了決定。
在緊急授權的概念下,沒有明文規定要做第三期,而是看科學證據累積到哪裡,讓審查委員會有空間討論。科學本身會有限度,仍必須有人的決策跟判斷。比如說,傳統的臨床試驗要有99%的科學證據,剩下1%讓專家判斷,有十足信心就給予藥證;緊急授權下,沒有100%、90%的科學證據,只有80%或75%可以做證據性的推估,剩下25%基於緊急狀況,交給專業人性進行專業判定,必須衡量當前狀況、科學資料到哪來做決定。
郭旭崧說,國產新冠疫苗是否會釀信任危機,另一個關鍵因素是決策者必須有魄力,要跳出來一肩扛起,如果疫苗沒效還讓它通過,決策者就要負責任。如果官員不敢扛責,最好就不要讓疫苗過關,不要過就沒有責任,以前很多故事也是這樣,通過之後就有責任,因此需要決策者的魄力。
此外,郭旭崧也說,很重要的是,人民要有選擇疫苗的權利,不能強迫人民接種,執政者要把話講清楚,國產疫苗是怎麼做的、經過什麼樣的程序之後給予緊急授權,那人民打不打,人民可以選。
(三)楊秀儀說,政府評估是否給予緊急授權,應審酌當時可得的科學證據,評估藥品本身的效益大於其風險,且國內現有藥品無法滿足緊急醫療的需求,而藥品之於公共健康的利益大於等待其有效性資訊完備的風險,方得緊急授權。
也就是說,在台灣沒疫情時,當然應該要等做三期再來評估;但如果台灣情況危急,還要等到三期做到一定程度,國內承受疫情風險很大,以二期做完就申請緊急授權並無不可。
楊秀儀說,目前已知的幾個國際藥廠取得美國緊急授權,但他們申請時,也只有完成第二期,正在進行第三期。當時國外疫情狀況,要做第三期很容易,但現在台灣已經沒有做第三期臨床試驗的客觀條件。因第三期試驗必須在真實世界中觀察實驗組和對照組的結果,但現在已經有有效的疫苗問世,若要求試驗中一組人只能接受安慰劑,而排擠受試者接受疫苗接種的權利,會有研究倫理爭議。因此世界衛生組織日前也召開會議,評估以「免疫橋接研究」(Immuno bridging study )取代傳統第三期的可行性。
楊秀儀表示,在疫情嚴峻時期,重點應不是第二或第三期,而是是否有足夠科學數據判斷疫苗的安全和有效性,合理使用的效益大於風險。若國產疫苗在二期試驗後,中和抗體的價數經專家審查研判符合標準,那可不以第三期臨床試驗為必要。
楊秀儀建議,目前台灣法規對於「緊急授權」規範確實不夠完備,陽明交大團隊也提出藥事法修法建議,包含明確規範緊急授權的要件,且通過緊急授權也要有一些附帶條件,如限制藥品(疫苗)的運送或銷售對象,且要在特定期間內進行藥品安全性及有效性的資料收集跟分析。緊急授權也要有期限的限制,每次效期1年,可以每年申請展延。若藥品經認定有安全或效能疑慮,主管機關有廢止緊急授權,另授權期滿或廢止,主管機關也可命其回收。
此外,楊秀儀說,由於緊急授權生產或進口之藥品並未經過完整查驗登記,資訊公開及民眾知情同意的權利,攸關風險管理的透明度,因此法規也應明確規定緊急授權相關資訊的公開,使民眾瞭解取得緊急授權的疫苗僅做完第二期臨床試驗、有什麼風險等,讓民眾有評估的依據。
結論
一、美國食品藥物管理局(FDA)對於COVID-19疫苗的緊急使用授權審查,必須「基於第三期臨床試驗」或是此類試驗的中期分析。除需要提交一、二期的安全相關數據,也需提供第三期試驗中,過半受試者完成接種後,至少兩個月的追蹤數據,且第三期試驗者,至少需在3000名受試者以上。
二、輝瑞、莫德納疫苗在「完成二期試驗之後,正在進行三期試驗」時,以三期試驗報告取得美國FDA的緊急使用授權。但截至2021年6月7日為止,AZ疫苗尚未取得美國緊急授權。
三、針對國產新冠疫苗作完二期臨床試驗就申請食藥署的緊急使用授權,專家認為,食藥署應清楚說明緊急授權相關標準,秉持科學證據說話的原則,明確揭露國產COVID-19疫苗產製流程、標準和相關風險,讓民眾有選擇和判斷依據。
參考資料
美國食品藥物管理局(FDA)緊急使用授權的標準
〈高端新冠疫苗臨床二期試驗 3700名受試者已完成第二劑施打〉
"事實" - Google 新聞
June 08, 2021 at 06:39PM
https://ift.tt/3zeS4B0
【事實釐清】網傳「AZ、莫德納、輝瑞疫苗都是完成二期試驗,美國就發緊急使用授權EUA」? - 台灣事實查核中心
"事實" - Google 新聞
https://ift.tt/2wpE2jK
Shoes Man Tutorial
Pos News Update
Meme Update
Korean Entertainment News
Japan News Update
Bagikan Berita Ini














0 Response to "【事實釐清】網傳「AZ、莫德納、輝瑞疫苗都是完成二期試驗,美國就發緊急使用授權EUA」? - 台灣事實查核中心"
Post a Comment